O flavonóide procianidina C1 tem atividade senoterapêutica e aumenta o tempo de vida em camundongos
Resumo
O declínio funcional dos órgãos associado ao envelhecimento e o aumento do risco de patologias crônicas relacionadas à idade são motivados em parte pelo acúmulo de células senescentes, que desenvolvem o fenótipo secretor associado à senescência (SASP). Aqui, mostramos que a procianidina C1 (PCC1), um componente polifenólico do extrato de semente de uva (GSE), aumenta a expectativa de saúde e a vida útil de camundongos por meio de sua ação nas células senescentes. Ao rastrear uma biblioteca de produtos naturais, descobrimos que o GSE e o PCC1 como um de seus componentes ativos têm efeitos específicos nas células senescentes. Em baixas concentrações, o PCC1 parece inibir a formação de SASP, enquanto mata seletivamente as células senescentes em concentrações mais elevadas, possivelmente por promover a produção de espécies reativas de oxigênio e disfunção mitocondrial. Em modelos de roedores, O PCC1 esgota as células senescentes em um microambiente tumoral danificado pelo tratamento e aumenta a eficácia terapêutica quando coadministrado com quimioterapia. A administração intermitente de PCC1 a camundongos irradiados, implantados com células senescentes ou envelhecidos naturalmente alivia a disfunção física e prolonga a sobrevivência. Identificamos PCC1 como um agente senoterapêutico natural com atividade in vivo e alto potencial para desenvolvimento posterior como uma intervenção clínica para retardar, aliviar ou prevenir patologias relacionadas com a idade.
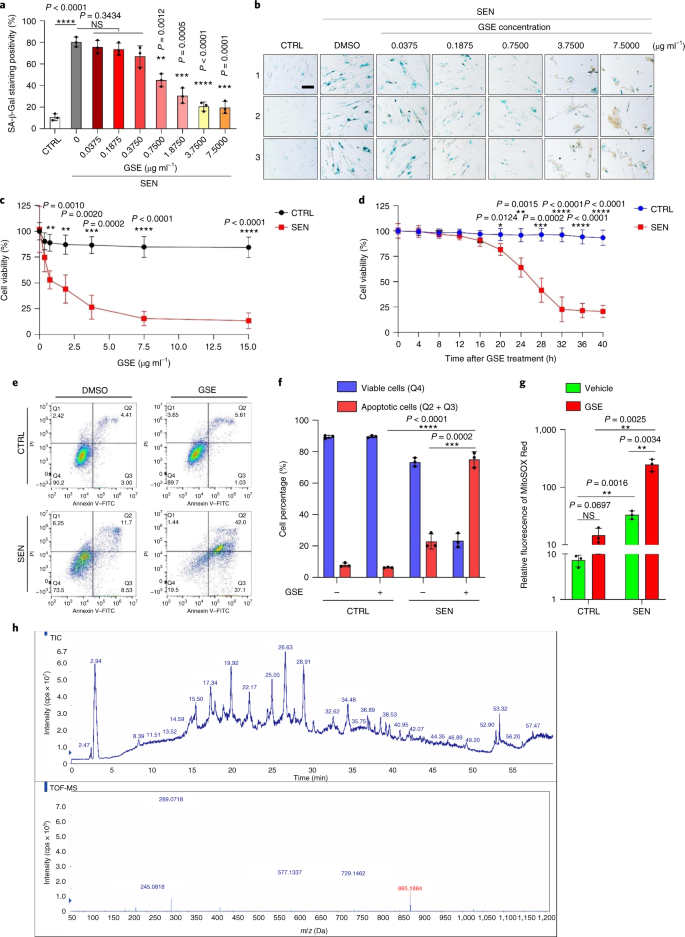
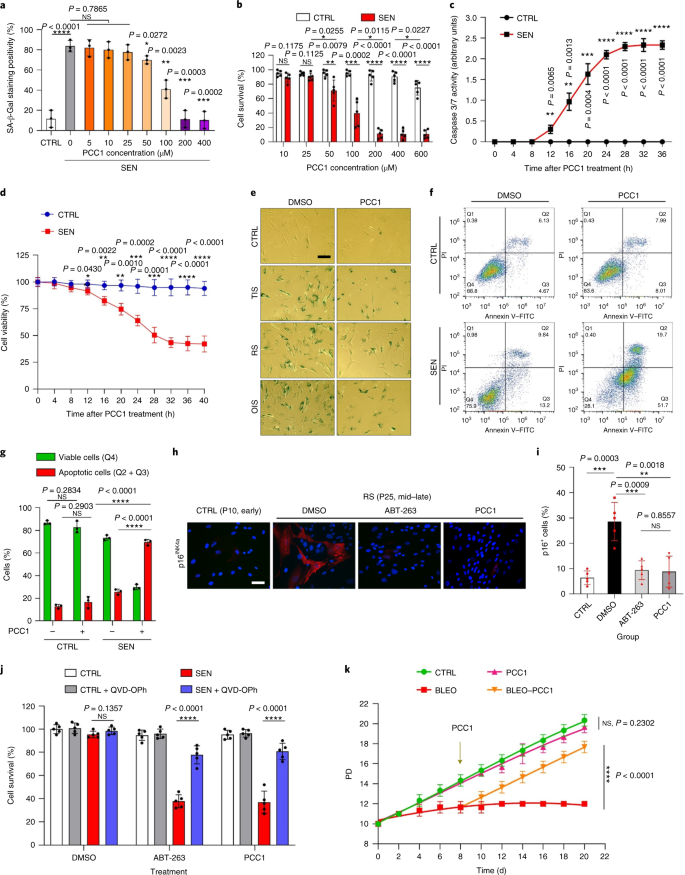
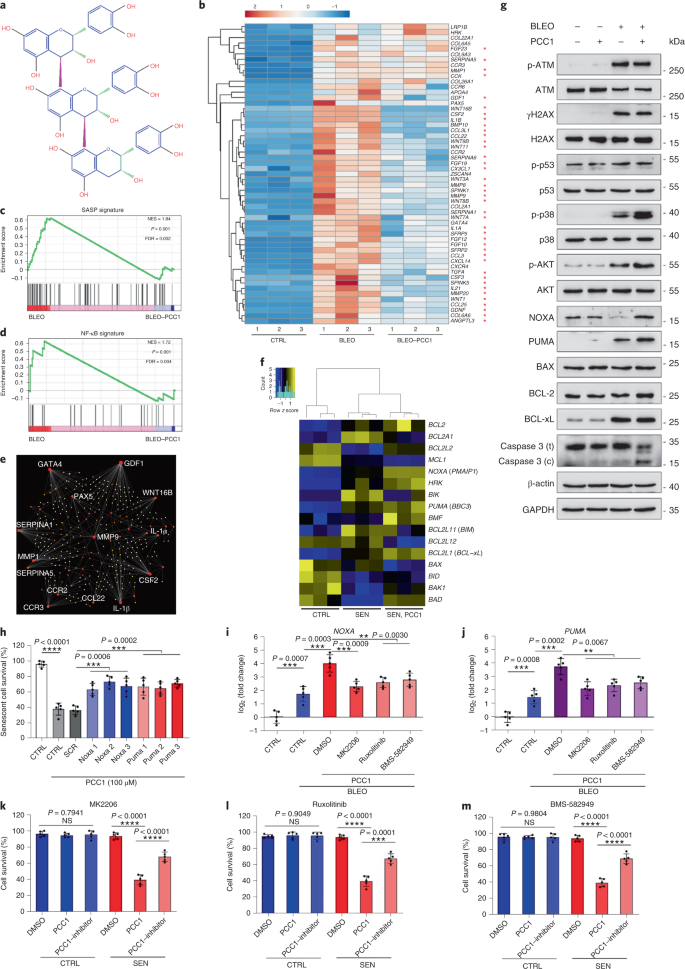
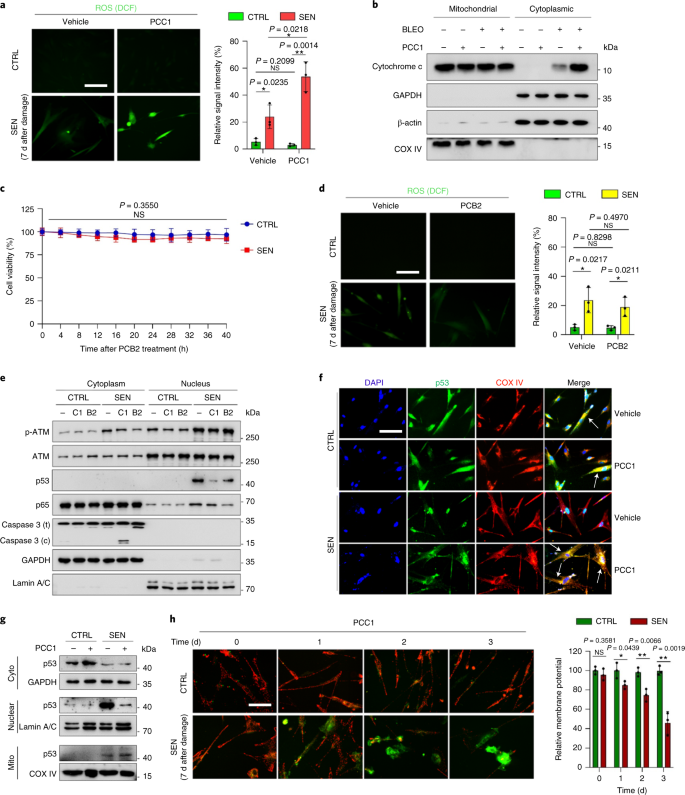
O envelhecimento é um dos maiores fatores de risco para doenças crônicas, incluindo doenças cardiovasculares, distúrbios metabólicos, patologias neurodegenerativas e diversas doenças malignas, que juntos respondem pela maior parte dos custos de morbidade, mortalidade e saúde globalmente1. Progressos consideráveis foram feitos nos últimos anos para desenvolver agentes específicos para tratar condições individuais relacionadas à idade, como diabetes tipo 2, osteoporose, fragilidade esquelética e disfunção vascular. No entanto, o efeito combinado dessas drogas no controle da morbimortalidade por doenças crônicas tem sido modesto, e essas doenças tendem a ocorrer em sincronia como multimorbidades, com prevalência aumentando exponencialmente após os 70 anos de idade.2. Vários fatores importantes que afetam a expectativa de saúde e a expectativa de vida foram identificados por meio de estudos em uma variedade de espécies e definidos como mecanismos de envelhecimento que podem ser categorizados em nove características3. Destes mecanismos fundamentais de envelhecimento, a senescência celular tem recebido atenção substancial, pois representa um processo drogável que previne ou retarda várias comorbidades do envelhecimento4. Relatada pela primeira vez na década de 1960, a senescência celular refere-se a um estado celular envolvendo parada replicativa essencialmente irreversível, alterações profundas da cromatina, resistência à apoptose e aumento da síntese de proteínas, frequentemente culminando na superprodução de citocinas pró-inflamatórias, uma característica denominada SASP, que se acredita conduzem fenótipos de envelhecimento e várias patologias relacionadas com a idade5. Ablação de células senescentes positivas para o marcador de senescência p16INK4A mitiga a degeneração do tecido e estende a saúde do animal, apoiando a alegação de que as células senescentes desempenham um papel causador no envelhecimento do organismo6,7. O sucesso em estudos pré-clínicos inspirou o início de ensaios clínicos de prova de conceito envolvendo senolíticos para várias doenças humanas com o potencial de diminuir a carga de células senescentes in vivo por meio da eliminação farmacológica seletiva8,9,10. Desde a primeira descoberta em 2015 (ref. 11), um punhado de agentes senolíticos sintéticos ou de moléculas pequenas são agora conhecidos. As estratégias de direcionamento baseiam-se principalmente no mecanismo de resistência das células senescentes à apoptose, que parece depender de vias antiapoptóticas associadas à senescência que permitem a sobrevivência das células senescentes por períodos prolongados12,13. A administração intermitente de senolíticos tem o potencial de reduzir o risco de pacientes desenvolverem condições adversas, minimizar os efeitos indesejados das drogas e prevenir o desenvolvimento de resistência às drogas das células senescentes, que não se dividem, uma característica que as diferencia das células cancerosas, como as células cancerosas freqüentemente adquirem mutações vantajosas que fornecem resistência contra terapias anticâncer. No entanto, a maioria dos senolíticos relatados são dependentes da linhagem celular ou tipo de célula ou, alternativamente, exibem citotoxicidade substancial in vivo, limitando assim seu uso potencial para fins clínicos. Neste estudo, examinamos uma biblioteca de medicamentos de produtos naturais composta por agentes anti-envelhecimento e identificamos vários candidatos, incluindo GSE. Uma análise posterior revelou que o PCC1, um componente da epicatequina trímero do tipo B dos flavonóides GSE, desempenha um papel importante na inibição da expressão de SASP em baixas concentrações e na morte de células senescentes em concentrações mais altas, o último através da indução de apoptose. Os dados pré-clínicos sugeriram que, em combinação com a quimioterapia clássica, o PCC1 pode reduzir significativamente o tamanho do tumor e prolongar a sobrevida em vários modelos de camundongos. Assim, o PCC1 representa uma nova classe de senolíticos fitoquímicos isolados de fontes naturais que atrasam o envelhecimento e melhoram os distúrbios relacionados à idade e garante uma exploração mais aprofundada como um potencial agente geroprotetor na medicina clínica. Em um esforço para identificar novos compostos que podem modular eficazmente as células senescentes, a triagem de agente imparcial foi realizada com uma biblioteca fitoquímica composta por 46 agentes medicinais derivados de plantas (biblioteca PDMA). Nós empregamos uma linha de células estromais de próstata humana normal primária, PSC27, como um modelo baseado em células para este propósito. Composto principalmente por fibroblastos, mas com uma pequena porcentagem de linhagens celulares não fibroblásticas, incluindo células endoteliais e células musculares lisas, PSC27 é uma linha celular primária per se e desenvolve um SASP típico após a exposição a estressores, como quimioterapia genotóxica ou radiação ionizante14,15,16,17. Tratamos essas células com uma dose subletal pré-otimizada de bleomicina (50 μg ml-1) e coloração de β-galactosidase (SA-β-Gal) associada à senescência aumentada, incorporação de 5-bromodeoxiuridina diminuída e focos de reparo de dano de DNA (DDR) elevados 7–10 d após (Fig. Suplementar 1a - c) Nós configuramos uma estratégia de triagem para comparar os efeitos que os medicamentos individuais tiveram na sobrevivência e no perfil de expressão de células senescentes (Fig. Dados Estendidos 1a) Uma vantagem promissora dos agentes senolíticos é induzir seletivamente a morte programada de células senescentes, como ABT-263, ABT-737 e o uso combinado de dasatinibe e quercetina11,18,19. Primeiro testamos a eficácia dessas drogas geroprotetoras contra células PSC27 senescentes para demonstrar seu potencial como um modelo de célula experimental para a triagem de drogas. Nossos dados preliminares sugeriram que cada um desses compostos esgotou significativamente as células senescentes, mas não as células em proliferação, confirmando assim a viabilidade de usar esta linha estromal para estudos adicionais (Fig. Dados Estendidos 1b) Após a triagem em grande escala da biblioteca de PDMA, identificamos vários compostos com potencial para matar seletivamente as células senescentes em cultura (Figura de dados estendidos 1c–e) Entre os agentes que mostram efeitos anti-senescência preliminares estavam GSE, quercetina, fisetina, curcumina e piperlongumina (Extended Data Fig. 1d, e) A quercetina e a fisetina compartilham estruturas químicas semelhantes, exercem efeitos medicinais semelhantes e são ambas senolíticas conhecidas11,20,21. A curcumina e a piperlongumina também são compostos naturais com potencial senolítico recentemente descoberto22,23. Optamos por nos concentrar no IGE, que continuou sendo uma fonte pouco explorada. Sob condições in vitro, GSE suprimiu o SASP com eficiência máxima em 0,1875 μg ml-1 (Dados estendidos Fig. 2a), que se encaixa com a propriedade de senomórficos24. Concentrações mais baixas ou mais altas de GSE foram menos eficazes, talvez devido à indução de respostas de estresse celular como resultado do aumento da citotoxicidade (Figura de dados estendidos 2a) Usando RNA-seq, descobrimos que o tratamento com GSE alterou significativamente o perfil de expressão das células de senescência, com 2.644 genes regulados negativamente e 1.472 genes regulados positivamente em uma alteração de 2,0 por gene (P <0,01) (Dados estendidos Fig. 2b) Embora a expressão de alguns genes não relacionados ao SASP mostrou uma tendência semelhante à de fatores SASP típicos (Extended Data Fig. 2c), os dados de nossa análise de enriquecimento de conjunto de genes (GSEA) apoiaram a expressão reduzida de assinaturas moleculares do SASP ou ativação do complexo de fator nuclear (NF) -κB, que é um mediador chave do fenótipo pró-inflamatório (Extended Data Fig. 2d, e) A translocação nuclear de p65, uma das principais subunidades do complexo NF-κB, foi observada em células senescentes, consistente com seu envolvimento funcional na expressão de SASP14 (Dados estendidos Fig. 2f) Digno de nota, essa tendência foi substancialmente antagonizada por GSE em baixas concentrações (como 0,1875 μg ml-1) Por outro lado, a ativação da sinalização de NF-κB não foi suprimida, mas pareceu aumentada quando GSE foi usado em concentrações mais altas (como 3,7500 μg ml-1), sugerindo respostas diferenciais de células senescentes nessas condições de tratamento. A ativação da sinalização DDR, conforme evidenciado pela fosforilação da ATM quinase em frações nucleares, e a expressão do ligante de quimiocina do motivo C – X – C (CXCL) 8, um dos fatores marcantes SASP, conforme observado nas frações citoplasmáticas, foram consistentes com NF -κB ativação nessas configurações (Extended Data Fig. 2f) O perfil de interação proteína-proteína revelou uma rede altamente ativa envolvendo vários fatores significativamente regulados positivamente após a senescência celular, mas regulados negativamente, uma vez que as células foram expostas a GSE (Extended Data Fig. 3a) O perfil de ontologia gênica revelou que essas moléculas estão funcionalmente envolvidas em processos biológicos e associadas a componentes celulares geralmente consistentes com a natureza secretada do SASP (Extended Data Fig. 3b, c) Assim, o GSE é um produto natural que possui potencial para controlar o perfil pró-inflamatório das células senescentes, o SASP, quando utilizado dentro de uma faixa de concentração específica. Embora GSE não fosse o único produto natural com eficácia senolítica em nossos ensaios baseados em células (Extended Data Fig. 1d, e), nosso estudo subsequente se concentrou amplamente em GSE, pois sua capacidade geroprotetora parecia particularmente notável. Dada a eficácia do GSE em reduzir o SASP como um agente senomórfico, questionamos a seguir o potencial desse produto natural em matar células senescentes em concentrações mais altas, agindo como um senolítico. A coloração de SA-β-Gal indicou que as células senescentes foram eliminadas a uma concentração de GSE de 0,75 μg ml-1 (FIG. 1a, b) Em 3,75 μg ml-1 GSE, um patamar de 20% de sobrevivência das células senescentes foi atingido (Fig. 1a, b) uma, Quantificação da sobrevivência das células PSC27 senescentes pela positividade de SA-β-Gal. GSE foi aplicado ao meio em concentrações crescentes. CTRL, células de controle (proliferação); SEN, células senescentes; NS, não significativo. P os valores foram calculados por ANOVA de um fator com o teste de comparações múltiplas de Tukey. b, Imagens representativas exibindo coloração de SA-β-Gal após o tratamento de células PSC27 com diferentes concentrações de GSE. Barra de escala, 20 μm. Os dados são representativos de três experimentos independentes. DMSO, dimetilsulfóxido. c, Análise de sobrevivência de células PSC27 de controle e senescentes após tratamento com GSE (nas concentrações de 0,3750, 0,7500, 1,8750, 3,7500, 7,5000 e 15,0000 μg ml-1, respectivamente). Os dados são mostrados como média ± dp e foram derivados de três réplicas biológicas (n = 3 ensaios independentes). P os valores foram calculados por dois lados t-testes. d, Medição de curso de tempo de viabilidade in vitro após o tratamento de células PSC27 de controle e senescentes com GSE (3,75 μg ml-1) Os dados são mostrados como média ± dp e foram derivados de três réplicas biológicas (n = 3 experimentos independentes). P os valores foram calculados por dois lados t-testes. E, Medição de citometria de fluxo de células PSC27 de controle e senescentes após processamento com um kit de anexina V – FITC e iodeto de propídio (PI) e coloração de 4,6-diamidino-2-fenilindol (DAPI) para determinar a extensão da apoptose. Q1 – Q4, quartis 1–4. f, Quantificação comparativa da porcentagem de viabilidade (Q4, PI-anexina V-) e apoptótica (Q2 e Q3, PI+anexina V+ e PI-anexina V+, respectivamente) células em populações de controle ou senescentes tratadas com veículo ou GSE por 3 d (n = 3 ensaios biologicamente independentes). P os valores foram calculados por dois lados t-testes. g, Medição do sinal de fluorescência de MitoSOX Red, um indicador de superóxido mitocondrial, em células PSC27 sob diferentes condições. P os valores foram calculados por dois lados t-testes. h, Espectro de massa de alta resolução mostrando o cromatograma de íon total (TIC) e o cromatograma de pico de base de GSE após realizar HPLC-ESI-QTOF-MS. Salvo indicação em contrário, as células foram submetidas a análises relevantes 3 dias após o tratamento com GSE na condição de cultura. cps, contagens por segundo. Os dados em gráficos de barras e curvas de regressão são mostrados como média ± dp e são representativos de três repetições biológicas. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Os ensaios de viabilidade celular mostraram que o GSE induziu a morte celular senescente, mas não a morte celular proliferativa a partir de uma concentração de 0,75 μg ml-1 (FIG. 1c) A uma concentração de 7,50 μg ml-1, a porcentagem de células senescentes sobreviventes diminuiu para aproximadamente 10%, enquanto a viabilidade das células em proliferação não foi afetada mesmo em 15,00 μg ml-1 GSE (Fig. 1c), a maior concentração usada em nossos ensaios de células, sugerindo seletividade e especificidade proeminentes de GSE contra células senescentes, que são as principais características dos senolíticos. Em seguida, medimos a capacidade do GSE de alvejar diferencialmente as células senescentes em um curso de tempo. Após o tratamento com GSE a uma concentração de 3,75 μg ml-1, a viabilidade das células senescentes não diminuiu significativamente até após 20 h. A diferença de viabilidade entre as células senescentes e o controle (células em proliferação) atingiu um máximo após 32 h, implicando em heterogeneidade da resistência intrínseca aos senolíticos em populações de células senescentes (Fig. 1d) Como o GSE gera efeitos distintos contra as células senescentes, analisamos a eficácia do GSE na indução da apoptose celular. A citometria de fluxo demonstrou viabilidade significativamente reduzida, enquanto a apoptose das células senescentes, mas não das células em proliferação, foi elevada (Fig. 1e, f e a Fig Suplementar. 2a) A disfunção mitocondrial e as alterações metabólicas estão entre as marcas registradas das células senescentes e do envelhecimento do organismo, eventos que causam estresse oxidativo e produção de espécies reativas de oxigênio (ROS), como o superóxido3,25. Usamos MitoSOX Red, um indicador de superóxido mitocondrial26, para sondar mudanças intercelulares e descobriu que GSE promoveu a geração de ROS mitocondriais em células senescentes, mas não em células em proliferação (Fig. 1g) Assim, nossos dados são consistentes com um modelo no qual GSE mata células senescentes por meio da indução de apoptose e exacerbação do estresse mitocondrial in vitro. As sementes da uva somam 38-52%, com base na matéria seca, das uvas e constituem uma fonte abundante de antioxidantes27. Aplicamos cromatografia líquida de alta pressão (HPLC) acoplada a espectrometria de massa de tempo de vôo quadrupolo (QTOF-MS) equipada com uma interface de ionização por electrospray (ESI) para identificar os principais componentes de GSE. Encontramos três categorias principais de fitoquímicos, incluindo ácidos fenólicos, flavonóides (como flavan-3-ol, procianidinas) e outros compostos (Fig. 1h e Tabela Complementar 1) Entre eles, alguns componentes foram identificados como procianidinas e seus derivados, que foram relatados para atingir proteínas mitocondriais e aliviar várias doenças crônicas28. No entanto, o (s) principal (is) componente (s) que medeiam a função senolítica de GSE permanece em grande parte obscuro. As atividades biológicas relatadas das procianidinas da semente de uva incluem redução do dano oxidativo, supressão da inflamação e indução da apoptose das células cancerosas29,30,31,32. Entre os compostos individuais encontrados em GSE, PCC1 merece atenção especial, pois foi mostrado para induzir danos ao DNA, causar parada do ciclo celular e aumentar a expressão de quinases de ponto de verificação33. Os dados da análise preliminar (cromatograma de íon total) de GSE, uma mistura de agentes fitoquímicos per se, por HPLC-QTOF-MS sugeriram a presença de PCC1, como o perfil de GSE em picos de MS específicos combinados com o perfil do cromatograma de PCC1 quimicamente puro adquirido de uma fonte comercial (Fig. 1h e a Fig Suplementar. 2b) Foi demonstrado que PCC1 diminui o nível de BCL-2, mas aumenta a expressão do regulador BAX e as atividades das caspases 3 e 9 em células cancerosas em cultura, gerando potencialmente efeitos anticâncer por meio da indução de apoptose33. Portanto, avaliamos a seguir a capacidade e seletividade de PCC1 para eliminar células senescentes em cultura. Os dados sugerem que PCC1 é senolítico para células estromais senescentes começando em uma concentração de 50 μM, na qual as células em proliferação permanecem praticamente inalteradas (Fig. 2a, b e Tabela Complementar 2) Embora concentrações mais altas tenham causado uma menor taxa de sobrevivência de células senescentes, com um limite de aproximadamente 200 μM, o PCC1 apenas exibiu toxicidade para as células de controle quando usado a 600 μM ou superior (Fig. 2b) Um curso de tempo da atividade da caspase 3/7 indicou que PCC1 exerceu efeitos apoptóticos em 12 h, atingindo um platô em 24 h (Fig. 2c) Este achado foi amplamente consistente com as medições de viabilidade (Fig. 2d) A natureza senolítica do PCC1 foi confirmada por células que entraram na senescência devido à exaustão replicativa ou senescência (RS) ou oncogene (HRASG12V) superexpressão (OIS), que gera insultos estressantes semelhantes aos da senescência induzida por terapia (Fig. 2e, Dados estendidos Fig. 4b - e e Tabela Complementar 2) Juntos, os resultados sugerem que o PCC1 limpa seletivamente as células estromais humanas senescentes induzidas por diferentes estímulos de uma maneira dependente da dose, mas sem um efeito significativo nas células não-senescentes quando usado em concentrações apropriadas. uma, Medição da sobrevivência das células PSC27 senescentes por coloração com SA-β-Gal. PCC1 foi aplicado em concentrações crescentes. P os valores foram calculados por ANOVA de um fator com o teste de comparações múltiplas de Tukey. b, Sobrevivência de células PSC27 senescentes induzidas por bleomicina em concentrações crescentes de PCC1. c, Ensaio apoptótico para atividade da caspase 3/7. d, Curvas de sobrevivência ao longo do tempo para avaliar a viabilidade das células PSC27 após o tratamento com PCC1. E, Imagens de coloração de SA-β-Gal. TIS, senescência induzida por terapia (por bleomicina). Barra de escala, 20 μm. Os dados são representativos de três experimentos independentes. f, Citometria de fluxo após processamento com anexina V – FITC e kit PI e coloração DAPI para determinar os níveis de apoptose. g, Quantificação da porcentagem de viabilidade (Q4, PI-anexina V-) e apoptótica (Q2 e Q3, PI+anexina V+ e PI-anexina V+, respectivamente) células após o tratamento com veículo ou PCC1 por 3 d (n = 3 ensaios biologicamente independentes). h, Coloração por imunofluorescência de células PSC27. RS foi induzida por passagem em série antes do tratamento com PCC1. Vermelho, p16INK4a. As células em uma passagem inicial (P10) foram usadas como controle negativo. ABT-263 (1,25 μM) foi testado como um controle positivo. Barra de escala, 20 μm. eu, Estatísticas de coloração por imunofluorescência. j, Atividade senolítica induzida por PCC1 após inibição de pan-caspase (20 μM QVD-OPh). para, Ensaio de PD de MSCs humanos. O PCC1 foi aplicado no 8º dia após o início dos experimentos conforme indicado. BLEO, bleomicina. Por c,d,para, os dados são mostrados como média ± dp e foram derivados de três réplicas biológicas (n = 3 ensaios independentes). Para dados em b-d,g,eu,j, P os valores foram calculados por dois lados t-testes. Em experimentos para c-para, PCC1 foi usado a 100 μM. Salvo indicação em contrário, as amostras foram coletadas para análises 3 dias após o tratamento com PCC1. Os dados em gráficos de barras são mostrados como média ± dp e são representativos de três réplicas biológicas. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Para expandir experimentalmente e estabelecer a eficácia de PCC1 através de linhagens celulares, tratamos fibroblastos de pulmão fetal humano (WI38), células endoteliais da veia umbilical humana primária (HUVECs) e células-tronco mesenquimais humanas (MSCs) com PCC1 e descobrimos que células senescentes de todas essas linhagens exibiam suscetibilidade semelhante para ablação seletiva por PCC1, ao passo que suas contrapartes não senescentes permaneceram viáveis (Extended Data Fig. 4f-h e Tabela Complementar 3) Confirmamos ainda a indução de apoptose em células senescentes em resposta a PCC1 por citometria de fluxo, enquanto as células em proliferação permaneceram amplamente não afetadas por PCC1 (Fig. 2f, g) Em suma, nossos dados mostram que o PCC1 elimina seletivamente células senescentes em vários tipos de células e decorrentes de diferentes gatilhos de senescência. Para visualizar a depleção de células senescentes por PCC1, examinamos a expressão de p16INK4a, um marcador de senescência amplamente utilizado em células do estroma que sofreram RS. PCC1 removeu efetivamente células senescentes p16-positivas, que só apareceram em populações PSC27 de passagem tardia, com uma eficácia muito semelhante à de ABT-263 (1,25 μM), um agente senolítico sintético bem estabelecido18,21 (FIG. 2h, eu) Para comprovar que a eliminação de células senescentes mediada por PCC1 ocorre principalmente por meio da indução de apoptose, ao invés de outras formas de morte celular programada, tratamos as células com o inibidor de apoptose pan-caspase quinolil-valil-O-metilaspartil - (- 2,6-difluorofenoxi) -metilcetona (QVD-OPh). A capacidade do PCC1 de matar células senescentes foi revertida por QVD-OPh. PCC1, portanto, compartilha sua indução de apoptose dependente de caspase como uma característica senolítica com ABT-263 (Fig. 2j) Uma análise posterior com inibidores químicos excluiu a morte celular induzida por PCC1 por meio de ferroptose, piroptose ou necroptose (Fig. Dados Estendidos 4i) Para avaliar o potencial de duplicação da população de células (PD) após o tratamento com drogas genotóxicas, empregamos MSCs, que podem se auto-renovar e retomar a proliferação baseada em colônias, mesmo após a exposição a estresses ambientais34, provavelmente devido à heterogeneidade do dano, com as células experimentando menos danos, presumivelmente capazes de reter o potencial de autorrecuperação e reentrada no ciclo celular24,35. Ao contrário das células danificadas por bleomicina, que rapidamente entraram em parada de crescimento após o tratamento, o tratamento pós-senescência com PCC1 aumentou significativamente a capacidade de DP das MSCs, especialmente após a remoção de células senescentes desenvolvendo SASP e mantendo o potencial de induzir senescência parácrina dentro das populações de células (Fig. . 2k) No entanto, o tratamento com PCC1 não afetou o PD de células em proliferação, mais indicativo da seletividade de PCC1 para células senescentes em comparação com suas contrapartes normais. Como GSE é uma mistura fitoquímica complexa, com muitos de seus componentes tendo atividades antioxidantes e antiinflamatórias relatadas27,36, investigamos se PCC1 era o principal constituinte de GSE envolvido na depleção de células senescentes ou se fitoquímicos alternativos em GSE poderiam contribuir para seu efeito senolítico geral. Para este fim, examinamos a influência de moléculas fitoquímicas individuais na sobrevivência de células PSC27 senescentes. A maioria dos componentes de GSE falhou em exibir atividade senolítica na faixa de dose de PCC1 e não causou morte significativa de células em proliferação (Figs suplementares. 3 e 4) Embora a quercetina flavonóide tenha mostrado atividade senolítica como em nossos estudos anteriores, uma propriedade compartilhada com flavonas naturais11,21, 'GSE reconstituído', consistindo nos componentes principais misturados de acordo com sua porcentagem de massa, conforme revelado por nossos dados HPLC-QTOF-MS (Tabela Suplementar 1, observe que a quercetina é responsável por apenas 0,9%), mas excluindo propositalmente PCC1, não mostrou resultados semelhantes aos observados para PCC1 em ambos os ensaios (Figs suplementares. 3 e 4) Embora não possamos concluir se outros componentes têm uma contribuição, nossos dados sugerem claramente que o PCC1 é um mediador primário do efeito senolítico da GSE. Dada a eficácia proeminente do PCC1 na indução seletiva da morte celular senescente, interrogamos o (s) mecanismo (s) subjacente (s). PCC1 pertence à superfamília dos flavonóides, que podem eliminar os radicais livres, quelar metais e reduzir a formação de hidroperóxidos, propriedades antioxidantes atribuíveis ao grupo funcional '-OH' na estrutura e sua posição no anel da molécula de flavonóide27. A capacidade antioxidante das procianidinas é, em parte, governada por seu grau de polimerização, enquanto PCC1 é um trímero de epicatequina de procianidina por natureza (Fig. 3a) uma, Estrutura química da epicatequina trimérica PCC1. b, Mapa de calor representando genes principais (50) significativamente regulados positivamente em células PSC27 senescentes, mas com regulação negativa após tratamento com PCC1 (50 μM). Estrelas vermelhas, fatores SASP. c, Gráfico GSEA de um gene significativo definido no espectro SASP. FDR, taxa de descoberta falsa; NES, pontuação de enriquecimento normalizada. d, Gráfico de GSEA de um conjunto significativo de genes associados à sinalização mediada por NF-κB. E, Mapa do NetworkAnalyst de interações proteína-proteína de fatores típicos associados a SASP significativamente regulados positivamente em células senescentes, mas regulados negativamente pelo tratamento com PCC1. f, Mapa de calor mostrando a expressão diferencial de genes da família BCL-2 em células senescentes de controle, senescentes e tratadas com PCC1. g, Immunoblot de células PSC27 expostas a diferentes agentes. A expressão de fatores pró-apoptóticos e antiapoptóticos e moléculas associadas à sinalização DDR foi examinada. Caspase 3 (t), caspase 3 total; caspase 3 (c), caspase 3 clivada; p, fosforilado. β-actina e GAPDH, controles de carga. Os dados são representativos de três experimentos independentes. h, As células foram infectadas com três diferentes espécies de RNA em gancho curto que alvejam PREJUÍZO ou PUMA antes de ser exposto à bleomicina para induzir a senescência. Sete dias depois, as células foram tratadas com PCC1 (100 μM) por um período de 3 dias para induzir a apoptose. SCR, embaralhar. eu, PREJUÍZO a expressão foi determinada usando PCR quantitativo com transcrição reversa (RT – qPCR). As células foram tratadas com bleomicina para induzir senescência antes da exposição a 100 μM de PCC1 por 3 dias na ausência ou presença de 10 μM de MK2206, 10 μM de ruxolitinibe ou 20 nM de BMS-582949 para inibir a atividade de AKT, JAK1 e / ou JAK2 ou p38 MAPK, respectivamente. j, Um conjunto semelhante de ensaios de expressão RT – qPCR para PUMA usando as condições descritas em eu. para-m, Medição da viabilidade celular após o tratamento com PCC1 na ausência ou presença de MK2206 (para), ruxolitinib (eu) ou BMS-582949 (m), incluído para inibir a atividade enzimática de AKT, JAK1 e / ou JAK2 ou p38 MAPK, respectivamente. Para dados em c,d, P os valores foram calculados por ANOVA de uma via com comparação post hoc de Tukey. Significância estatística em h-m foi calculado usando dois lados t-testes ou ANOVA unilateral (teste de Dunnett). Os dados em todos os gráficos de barras são mostrados como média ± dp e representam três réplicas biológicas. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Primeiro, analisamos o impacto do PCC1 na expressão de células senescentes em todo o transcriptoma. A bioinformática mostrou que 4.406 genes foram significativamente regulados positivamente e 2.766 genes foram regulados negativamente em células do estroma após o tratamento com PCC1 (Fig. Suplementar 5a) Observamos uma grande variedade de fatores SASP, a expressão dos quais foi acentuadamente regulada positivamente durante a senescência celular, mas substancialmente regulada para baixo quando as células senescentes foram expostas a PCC1 (Fig. 3b) O perfil de GSEA mostrou que ambas as assinaturas SASP e NF-κB foram notavelmente suprimidas pelo tratamento com PCC1 (Fig. 3c, d) Notamos ainda várias interações mútuas ou conexões funcionais entre esses fatores regulados positivamente durante a senescência e regulados negativamente após o tratamento com PCC1 aparecendo na lista dos principais genes diferencialmente expressos, a maioria dos quais eram fatores tipicamente secretados (Fig. 3e) Para entender a seletividade de PCC1 para células senescentes, avaliamos ainda o perfil de expressão transcriptômica e notamos que PCC1 induziu alterações de expressão em alguns membros da superfamília BCL-2 (Fig. 3f) Embora a sinalização DDR tenha permanecido amplamente inalterada, a sobrerregulação ou ativação dependente de PCC1 da proteína quinase ativada por mitogênio p38 (MAPK) foi observada, com a clivagem da caspase 3 ocorrendo nessas células (Fig. 3g) Embora a expressão de BCL-xL tenha sido elevada em células senescentes em relação àquela em seus controles em proliferação, o tratamento com PCC1 não aumentou ainda mais seu nível de proteína. Os níveis dos outros dois fatores BCL-2, a saber, BCL-2 e BAX, permaneceram praticamente inalterados. Enquanto NOXA e PUMA (dois membros do domínio de homologia BCL-2 3 (BH3) - apenas subfamília pró-apoptótica) exibiram diferentes padrões de expressão durante a senescência celular, o tratamento com PCC1 resultou na regulação positiva de ambos os fatores (Fig. 3g) A destruição de fatores pró-apoptóticos de BCL-2 sugeriu que NOXA e PUMA mediaram parcialmente as ações senolíticas de PCC1 (Fig. 3h e dados estendidos Fig. 5a – c) O tratamento com inibidores químicos de AKT quinase, Janus quinase (JAK) 1, JAK2 e sinalização p38 MAPK também sugeriu o envolvimento dessas vias de sinalização na expressão de PMAIP1 (PREJUÍZO) e BBC3 (PUMA) e apoptose de células senescentes após o tratamento com PCC1 (Fig. 3i – m) Como derrubando PREJUÍZO e PUMA inibiu apenas parcialmente o efeito senolítico de PCC1 (Fig. 3h, k - m), investigamos outro (s) possível (s) mecanismo (s) que levam à morte celular senescente. Como as procianidinas geralmente aumentam a viabilidade celular, diminuem a produção de ROS e restringem o estresse oxidativo em células de mamíferos37,38, perguntamos a seguir se efeitos semelhantes ou antioxidantes podem ser observados em células senescentes expostas ao PCC1. Surpreendentemente, descobrimos que o oposto era o caso, uma vez que as células PSC27 senescentes exibiam níveis elevados de ROS quando tratadas com PCC1, em contraste com suas contrapartes em proliferação (Fig. 4a e dados estendidos Fig. 5d, observe os sinais da sonda de diacetato de 2′-7′-diclorodi-hidrofluoresceína (DCFH-DA)). Tratamento com HS-1793, um análogo de resveratrol estável que tem atividade de eliminação de radicais livres39, bloqueou efetivamente a produção de ROS em células senescentes tratadas com PCC1 (Extended Data Fig. 5e, f), enquanto os níveis de ROS aumentaram ainda mais após a exposição de células senescentes tratadas com PCC1 a CCCP, um desacoplador mitocondrial protonóforo40, ou ruxotemitida (LTX-315), um peptídeo catiônico anfipático que induz a permeabilização da membrana mitocondrial externa41, cada um aplicado em concentrações que não eram citotóxicas para células de controle (Extended Data Fig. 5e, f) Embora o tratamento com CCCP ou ruxotemitida per se também tenha causado aumento na produção de ROS, os efeitos foram geralmente menores do que aqueles induzidos por PCC1, sugerindo que PCC1 desencadeia disfunção mitocondrial em células senescentes. Medindo o índice apoptótico de células senescentes (atividade da caspase 3/7), descobrimos que o efeito induzido por PCC1 poderia ser ainda mais intensificado após a combinação de PCC1 com cada disruptor mitocondrial, mas suprimido após co-tratamento com HS-1793 (Extended Data Fig . 5g) uma, Medição dos níveis de ROS com DCFH-DA, uma sonda fluorescente permeável às células e sensível a mudanças no estado redox celular. Os experimentos foram realizados 1 d após o tratamento com PCC1. Esquerda, imagens representativas. Barra de escala, 10 μm. Certo, estatísticas. DCF, diclorodihidrofluoresceína. b, Immunoblot após exposição de células a diferentes tratamentos. A distribuição do citocromo c entre as mitocôndrias e o citoplasma foi traçada pelo isolamento das mitocôndrias dos sobrenadantes do citosol 3 dias após o tratamento com PCC1. COX IV é a enzima terminal da cadeia respiratória mitocondrial e um marcador mitocondrial. c, Curvas de sobrevivência ao longo do tempo para avaliar a viabilidade das células PSC27 após o tratamento com PCB2, outro membro da família natural da procianidina. Os dados são mostrados como média ± dp e foram derivados de três réplicas biológicas (n = 3 ensaios independentes). d, Ensaio de produção de ROS realizado de maneira semelhante, conforme descrito em uma, exceto que as células foram expostas ao PCB2. Barra de escala, 10 μm. E, Immunoblot da expressão e distribuição de ATM, p53 e caspase 3 entre o citoplasma e o núcleo. GAPDH e lamina A / C, controles de carga para citoplasma e núcleos, respectivamente. C1, PCC1; B2, PCB2. f, Microscopia confocal de coloração por imunofluorescência após tratamento de células com veículo (DMSO) ou PCC1. Os anticorpos primários específicos para p53 ou COX IV foram aplicados. Barra de escala, 10 μm. g, Análise de imunotransferência de células PSC27 expostas a diferentes agentes. Citoplasmático; mito, mitocondrial. h, Análise de coloração de JC-1, uma sonda fluorescente indicativa de Δψm. Os sinais foram medidos ao longo de 3 d. A fluorescência verde indica monômeros JC-1 (eles aparecem no citosol após a despolarização da membrana mitocondrial e indicam apoptose em estágio inicial). Fluorescência vermelha indica agregação de JC-1 (reside em mitocôndrias intactas). Esquerda, imagens representativas. Certo, estatísticas. Tanto o PCC1 quanto o PCB2 foram usados a 100 μM em ensaios relevantes. Dados em b,E-g são representativos de três experimentos independentes. Significância estatística em uma (direito), d (direita) e h (direita) foi calculado usando dois lados t-testes, e isso em c foi calculado com ANOVA de uma via (teste de Dunnett). Os dados em todos os gráficos de barras são mostrados como média ± dp e são representativos de três repetições biológicas. NS, P > 0,05; *P <0,05; **P <0,01. A liberação do citocromo C e a ruptura da membrana mitocondrial são eventos intracelulares associados à apoptose e frequentemente agem como condutores apoptóticos diretos42. Nossos dados sugerem que o tratamento com PCC1 aumentou a liberação de citocromo c da mitocôndria para o espaço citoplasmático circundante (Fig. 4b e dados estendidos Fig. 5h) A liberação de citocromo c da mitocôndria é amplamente consistente com as reações bioquímicas, como a ativação da caspase em células senescentes tratadas com PCC1 (Fig. 3g) Os membros da família das procianidinas exibem um amplo espectro de propriedades farmacológicas, incluindo antioxidação e antiinflamatória, que são o oposto do que observamos ao tratar células senescentes com PCC1. Os dados atuais nos levaram a raciocinar se os efeitos do PCC1 são reproduzidos por outras procianidinas. Procianidina B2 (PCB2) é um flavonóide representativo que existe como um dímero e reduz os níveis de ROS durante o estresse oxidativo em células cultivadas43. O PCB2 não conseguiu eliminar as células senescentes (Fig. 4c e Figs suplementares. 3b e 4b) e nem aumentou a produção de ROS nem induziu a liberação mitocondrial de citocromo c em células senescentes (Fig. 4d e dados estendidos Fig. 5i) Uma quantidade substancial de p65 (RelA), uma das principais subunidades do complexo NF-κB, translocada para o núcleo das células senescentes (Fig. 4e) Embora o tratamento com PCB2 neutralize a translocação nuclear de p65, o que é consistente com sua capacidade anti-inflamatória, este efeito não foi reproduzido por PCC1 (Fig. 4e) As células senescentes expostas ao PCC1 exibiram notável clivagem da caspase 3, ao passo que aquelas tratadas com PCB2 não, diferenciando ainda mais a atividade biológica dessas duas moléculas de procianidina (Fig. 4e) Como um fator que governa funcionalmente o destino celular, o p53 pode induzir a apoptose transativando genes pró-apoptóticos ou de maneira independente da transcrição por translocação para a mitocôndria44. Observamos um aumento da translocação nuclear de p53 após a senescência celular, um padrão marcadamente reduzido por PCC1, mas muito menos do que pelo PCB2 (Fig. 4e, f) Como a exclusão nuclear de p53 é uma etapa crítica na indução da apoptose de células senescentes45, avaliamos ainda mais a distribuição de p53. A coloração por imunofluorescência indicou sobreposição substancialmente aumentada de p53 com a subunidade IV da citocromo c oxidase (COX IV) (um complexo de proteína transmembrana na cadeia de elétrons respiratórios mitocondriais, frequentemente usado como um marcador de proteína residente mitocondrial) em células senescentes tratadas com PCC1, sugerindo translocação aumentada de p53 na matriz mitocondrial. Embora tenhamos observado algum p53 nas mitocôndrias de células em proliferação, PCC1 não induziu um influxo notável ou abrangente da proteína p53 na matriz mitocondrial de células em proliferação (Fig. 4f) No entanto, em células senescentes, os níveis de p53 diminuíram nos núcleos, mas aumentaram nas mitocôndrias após a exposição ao PCC1 (Fig. 4g) O declínio do potencial de membrana mitocondrial (Δψm) é um evento que pode desencadear a apoptose através da via intrínseca mediada pela mitocondrial46. Descobrimos que Δψm foi significativamente reduzido em células senescentes, enquanto as células em proliferação permaneceram basicamente não afetadas na presença de PCC1, conforme indicado pelo perfil de sinais de sonda JC-1 (Fig. 4h) Assim, o PCC1 promove a geração de ROS, desencadeia a liberação de citocromo c e causa distúrbio Δψm em células senescentes, eventos inerentemente associados à deficiência mitocondrial e que conduzem funcionalmente a apoptose celular. Juntos, nossos dados experimentais sugerem que as células senescentes estão sujeitas à apoptose induzida por PCC1, um processo parcialmente mediado por PREJUÍZO e PUMA suprarregulação e associada com produção aumentada de ROS e disfunção mitocondrial. Dada a capacidade e seletividade do PCC1 para eliminar células senescentes in vitro, questionamos a seguir se este agente poderia ser explorado para intervir contra patologias relacionadas à idade in vivo. Na oncologia clínica, a resistência aos medicamentos limita a eficácia da maioria dos tratamentos anticâncer, enquanto as células senescentes frequentemente contribuem para a resistência terapêutica por meio do desenvolvimento de um SASP in vivo no microambiente tumoral danificado por medicamentos (TME)15,16,47. A eliminação farmacológica de células senescentes induzidas por terapia minimiza os efeitos colaterais da quimioterapia e previne a recorrência do câncer em animais48. No entanto, a viabilidade da depleção mediada por PCC1 de células senescentes de tumores primários para aumentar a eficácia dos tratamentos anticâncer permanece amplamente desconhecida. Em primeiro lugar, escolhemos construir tecidos recombinantes misturando células PSC27 com células PC3, que são uma linha celular típica de câncer de próstata de alta malignidade, em uma proporção pré-otimizada (1: 4)14. As células foram então implantadas por via subcutânea no flanco traseiro de camundongos com diabetes não obeso e imunodeficiência combinada grave (NOD-SCID). Os tumores dos animais foram medidos ao final de um período de 8 semanas e os tecidos foram adquiridos para avaliação patológica. Em comparação com os tumores que compreendem células cancerígenas PC3 e células do estroma PSC27 naive, os xenoenxertos compostos de células PC3 e células PSC27 senescentes exibiram um volume significativamente aumentado, confirmando os efeitos de promoção do crescimento tumoral das células senescentes (Fig. 6a) Para imitar as condições clínicas, projetamos experimentalmente um regime pré-clínico que incorpora terapêutica genotóxica e / ou senolítica (Fig. 5a) Duas semanas após a implantação subcutânea, quando a captação estável de tumores in vivo foi observada, uma única dose de mitoxantrona (MIT, um medicamento quimioterápico) ou placebo foi administrada aos animais no 1º dia da 3ª, 5ª e 7ª semanas até o final de o regime de 8 semanas (Extended Data Fig. 6b) Em contraste com o grupo tratado com placebo, a administração de MIT atrasou notavelmente o crescimento do tumor, validando a eficácia do MIT como um agente quimioterápico (redução de 44,0% no tamanho do tumor) (Fig. 5b) Notavelmente, embora a administração de PCC1 em si não tenha causado redução do tumor, o tratamento com MIT seguido por distribuição de PCC1 (a 20 mg por kg por meio de injeção intraperitoneal (ip) 2 semanas após a primeira dose de MIT e então entregue quinzenalmente) aumentou notavelmente a regressão do tumor (55,2 % de redução no tamanho do tumor em comparação com o MIT sozinho; redução de 74,9% no volume do tumor em comparação com o tratamento com placebo) (Fig. 5b) uma, Diagrama ilustrativo de um regime pré-clínico. Duas semanas após a implantação subcutânea e a absorção in vivo de tecidos recombinantes, os camundongos machos NOD-SCID receberam agentes únicos (mono) ou combinados (duplos) em um esquema metronômico composto por vários ciclos. BLI, imagem de bioluminescência. b, Perfil estatístico dos volumes finais do tumor. As células PC3 foram xenoenxertadas sozinhas ou em conjunto com células PSC27 no flanco traseiro dos animais. c, Avaliação comparativa da senescência in vivo por coloração com SA-β-Gal. Os tumores foram recentemente dissecados após matar os animais e processados como seções congeladas para coloração histológica. Barras de escala, 200 μm. d, Gráficos de violino que representam estatísticas comparativas de coloração de SA-β-Gal em tecidos tumorais. E, Ensaio de transcrição para a expressão in vivo de vários fatores SASP canônicos em células do estroma isoladas de tumores. Tecidos de animais xenoenxertados com células estromais e cancerosas foram submetidos a isolamento com microdissecção por captura a laser e processos subsequentes. Os dados são representativos de três réplicas biológicas (n = 10 animais por grupo). Os conjuntos de dados são exibidos como gráficos de caixa e bigode, nos quais uma caixa se estende do 25º ao 75º percentil com a mediana exibida como uma linha no meio e os bigodes indicando os valores menores e maiores. f, Profiling of SASP transcripts in stromal cells. Os sinais correspondentes a cada fator foram normalizados para aqueles do grupo tratado com veículo. Observação p16INK4a também é conhecido como CDKN2A e p21CIP1 também é conhecido como CDKN1A. g, Medição estatística de células com danos ao DNA e células apoptóticas em bioespécimes coletados conforme descrito em uma,b. Os valores são apresentados como a porcentagem de células coradas positivamente por imunohistoquímica (IHC) com anticorpos específicos para histona γH2AX ou caspase 3 (clivada). Por b,d-g, P os valores foram calculados por dois lados t-testes. h, Imagens IHC representativas da caspase 3 (clivada, CC3) no final dos regimes terapêuticos. Barras de escala, 100 μm. eu, Sobrevivência comparativa de camundongos mortos após o desenvolvimento de doenças volumosas avançadas. A duração da sobrevivência foi calculada a partir do momento da injeção do tecido recombinante até a morte do animal. MS, sobrevida média. P os valores foram calculados por testes de log-rank bilateral (Mantel-Cox). Dados em c,h são representativos de três experimentos independentes. Os dados em todos os gráficos de barras são mostrados como média ± dp e são representativos de três repetições biológicas. Em seguida, testamos se a senescência celular ocorreu nos focos de tumor desses animais. Sem surpresa, a administração de MIT induziu o aparecimento de um grande número de células senescentes no tecido tumoral. No entanto, a entrega de PCC1 a esses animais tratados com quimioterapia esgotou a maioria das células senescentes (Fig. 5c, d) A microdissecção de captura a laser seguida por ensaios de transcrição indicou expressão significativamente aumentada de fatores SASP, incluindo IL6, CXCL8, SPINK1, WNT16B (também conhecido como WNT16), GM-CSF (também conhecido como CSF2), MMP3 e IL1A, uma tendência acompanhada pela regulação positiva do gene que codifica o marcador de senescência p16INK4a em animais tratados com quimioterapia (Fig. 5e e dados estendidos Fig. 6c) Essas alterações foram observadas principalmente nas células do estroma, ao invés das células cancerígenas vizinhas, implicando na possibilidade de repovoamento de células cancerígenas residuais, que frequentemente desenvolvem resistência adquirida no TME danificado pelo tratamento. No entanto, após a administração de PCC1, as alterações associadas a SASP foram amplamente revertidas, conforme sugerido por ensaios de transcrição e RNA-seq (Fig. 5f e dados estendidos Fig. 6d) Para investigar os mecanismos subjacentes à expressão de SASP em camundongos tratados com MIT, dissecamos tumores de animais tratados com esses dois agentes 7 dias após a primeira dose de entrega de GSE, um ponto de tempo antes do desenvolvimento de colônias resistentes. Em contraste com o tratamento com placebo, a administração de MIT aumentou o dano ao DNA e a apoptose, enquanto o tratamento com PCC1 sozinho não aumentou (Fig. 5g) No entanto, quando animais tratados com MIT foram coadministrados com PCC1, o dano ao DNA e a apoptose aumentaram significativamente, implicando em citotoxicidade aumentada em animais recebendo quimioterapia e senolíticos. Como evidência de apoio, observamos clivagem elevada da caspase 3, uma característica típica da apoptose celular, quando PCC1 foi administrado junto com MIT (Fig. 5h) Em seguida, avaliamos as consequências da progressão do tumor, comparando a sobrevivência de diferentes grupos de animais ao longo do tempo. Nesta coorte pré-clínica, os animais foram monitorados quanto ao crescimento do tumor, com doença volumosa considerada como tendo surgido uma vez que a carga do tumor era proeminente (tamanho ≥ 2.000 mm3), uma abordagem empregada em estudos anteriores14,49. Os camundongos que receberam o tratamento combinatório MIT-PCC1 mostraram a sobrevida média mais prolongada, sobrevivendo pelo menos 48,1% mais do que o grupo tratado apenas com MIT (Fig. 5i, verde versus azul). No entanto, o tratamento com PCC1 sozinho estendeu apenas marginalmente a sobrevida. Nossos dados sugerem que a administração de PCC1 sozinha não altera o crescimento do tumor nem promove a sobrevivência animal, enquanto a co-administração de PCC1 com MIT tem efeitos sinérgicos significativos. De notar, os tratamentos realizados nestes estudos pareceram ser bem tolerados pelos animais, uma vez que não foram observadas perturbações significativas nos níveis de ureia, creatinina ou enzimas hepáticas ou peso corporal (Dados Extendidos Fig. 6e, f) Mais importante ainda, os agentes quimioterápicos e geroprotetores administrados em doses otimizadas neste estudo não interferiram significativamente na integridade do sistema imunológico ou na homeostase dos tecidos de órgãos críticos, mesmo em camundongos imunocompetentes (Fig. Suplementar 6a-c) Esses resultados apóiam o raciocínio de que os agentes anti-envelhecimento combinados com a quimioterapia convencional têm o potencial de aumentar a resposta do tumor sem causar toxicidade sistêmica grave. Mesmo um pequeno número de células senescentes pode induzir disfunção física em animais jovens50. Perguntamos se o PCC1 mata seletivamente as células senescentes in vivo e pode, assim, prevenir a disfunção física. Para resolver esta questão, realizamos implantação paralela de controle e fibroblastos embrionários de camundongo senescentes (MEFs, 0,5 × 106 células por lado) expressando luciferase constitutivamente (LUC+) por via subcutânea em camundongos singênicos de tipo selvagem (WT). Imediatamente após a implantação, os animais foram tratados com PCC1 (a 20 mg por kg via injeção ip) ou veículo (etanol-polietilenoglicol 400-Phosal 50 propilenoglicol (PG) às 10:30:60) por 7 d (Fig. 6a) Descobrimos que as intensidades do sinal de luminescência foram significativamente menores em camundongos implantados com células senescentes e tratados com PCC1 do que naqueles em ninhadas tratados com veículo, embora nenhuma diferença tenha sido observada após o tratamento de camundongos transplantados com LUC+ células de controle (Fig. 6b, c), comprovando a eficácia senolítica de PCC1 in vivo. uma, Esquema de procedimentos experimentais para transplante de células e testes de função física em camundongos machos C57BL / 6J de 5 meses de idade. b, Imagens representativas mostrando a atividade da luciferase in vivo 2 d após o último tratamento de camundongos. Barras de escala, 20 mm. c, Luminescência de células transplantadas como uma porcentagem em relação aos sinais médios em animais tratados com veículo. d-f, Medição da velocidade máxima de caminhada (em relação à linha de base) (d), resistência à suspensão (E) e força de preensão (f) em camundongos machos C57BL / 6J de 5 meses de idade, com testes realizados 1 mês após o último tratamento. g, Esquema do desenho experimental para transplante e medidas de função física. h-j, Medição da velocidade máxima de caminhada (em relação à linha de base) (h), resistência à suspensão (eu) e força de preensão (j) em camundongos machos C57BL / 6J com 28 semanas de idade (2 semanas após o último tratamento). para, Curvas de sobrevivência de um ano de animais de 17 meses implantados com 0,5 × 106 células de controle MEF e tratadas com veículo (CTRL-veículo) e camundongos implantados com 0,5 × 106 células senescentes MEF tratadas com veículo (veículo SEN) ou PCC1 (SEN-PCC1). Pontas de seta vermelhas, implantação de células (no 528º dia de idade) ou no final da medição da sobrevivência (890º dia de idade). P os valores foram calculados por testes de log-rank bilateral (Mantel-Cox). eu, Quantificação comparativa da carga da doença (esquerda) e carga tumoral (direita) (mostrada como mediana com intervalo interquartil) após implantação de células senescentes e tratamento com veículo ou PCC1. m, Causa da morte em animais que receberam células implantadas e foram tratados com veículo ou PCC1. Por d-f,h-j, os dados são mostrados como gráficos de caixa e bigode, nos quais as caixas se estendem do 25º ao 75º percentil com a mediana exibida como uma linha no meio, e os bigodes indicam os menores e os maiores valores. Por c-f,h-j, P os valores foram calculados por dois lados t-testes. Número de animais, n = 5 por grupo para c, n = 10 por grupo para d-j, n = 27 para para e n = 13 para eu,m. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Em seguida, investigamos se matar células senescentes implantadas usando PCC1 poderia atenuar eventos patológicos, especificamente disfunção física. O tratamento de animais jovens com PCC1 após implantação de células senescentes por 1 semana evitou declínios na velocidade máxima de caminhada (RotaRod), resistência de suspensão (teste de suspensão) e força de preensão (medidor de aderência), alterações observadas dentro de 1 mês após o tratamento com veículo de outro grupo de camundongos portadores células senescentes, consistentes com o potencial de PCC1 para reduzir a disfunção física (Fig. 6d-f) A administração de PCC1 também evitou a disfunção física que ocorreu em animais 5 semanas após a implantação de células senescentes (Fig. 6g) Em camundongos que abrigam células senescentes, um único curso de 5 dias de tratamento com PCC1 melhorou a função física em comparação com o tratamento com veículo (Fig. 6h - d) Digno de nota, a melhora foi detectável 2 semanas após o tratamento com PCC1 e ainda durou vários meses (Figura de dados estendidos 7a, b) Nestes dois momentos de administração de PCC1 (imediatamente versus 5 semanas após a implantação de células senescentes), os efeitos benéficos de PCC1 pareciam ser comparáveis. Os dados sugerem que o cronograma de administração do PCC1 pode ser flexível, o que indica sua potencial viabilidade clínica. Como procianidinas derivadas de sementes de plantas geralmente têm meia-vida de eliminação de <12 h51,52, tal melhora sustentada na função física após um único curso de tratamento com PCC1 contorna a necessidade de tratamento contínuo com o agente senolítico, implicando ainda que a atividade de PCC1 é suficiente para evitar a disfunção física induzida por células senescentes. Em seguida, procuramos avaliar o impacto das células senescentes ou o benefício de sua eliminação em animais de meia-idade. Para tanto, utilizamos camundongos C57BL / 6J com 17 meses de idade, os quais foram implantados com MEFs controle ou senescentes. Notavelmente, a sobrevivência de animais portadores de células senescentes e recebendo tratamento com veículo no ano seguinte foi significativamente menor do que a das contrapartes recebendo tratamento com PCC1, com um risco 2,4 vezes maior de morte (razão de risco, P = 0,0172) (Fig. 6k) No entanto, a carga da doença, a carga do tumor na morte e as causas da morte não foram significativamente diferentes entre os camundongos tratados com veículo e aqueles tratados com PCC1 (Fig. 6l, m) Esses dados sugerem que um pequeno número de células senescentes pode afetar a sobrevivência por meio de um processo geral, como acelerar a progressão do envelhecimento, em vez de causar alguma patologia específica ou algumas condições individuais. O aumento da carga de células senescentes resulta em disfunção física, uma tendência que está associada à mortalidade na meia-idade, mas pode ser adiada pela administração de senolíticos como PCC1. Os senolíticos esgotam as células senescentes em diversos tecidos e órgãos em várias situações fisiopatológicas, muitas das quais estão relacionadas com o envelhecimento53. Para examinar mais profundamente o efeito do PCC1 nas células senescentes em organismos e no envelhecimento do organismo, selecionamos dois modelos animais independentes de senescência in vivo, incluindo camundongos desafiados por terapia e camundongos que envelhecem naturalmente. Primeiro, induzimos a senescência celular expondo camundongos WT a irradiação de corpo inteiro (WBI) em uma dose subletal (5 Gy), uma etapa seguida por tratamento geroprotetor com PCC1 (20 mg por kg via injeção ip) ou veículo (etanol-polietileno glicol 400 – Phosal 50 PG às 10:30:60) (uma vez por semana) (Fig. 7a) Digno de nota, os animais que foram submetidos a WBI manifestaram uma aparência corporal anormal, incluindo cabelo marcadamente grisalho, que, no entanto, foi amplamente revertido pela administração de PCC1 (Fig. 7b, c) Células senescentes SA-β-Gal-positivas foram induzidas in vivo nestes animais, como evidenciado pelo aumento da positividade de coloração em tecidos cardíacos e pulmonares (Fig. 7d, e) No entanto, quando tratamos com PCC1 por injeção ip, a porcentagem de células positivas para SA-β-Gal em tecidos dissecados foi significativamente reduzida, ao contrário de camundongos tratados com veículo no estágio pós-WBI (Fig. 7f, g) O tratamento com PCC1 também diminuiu a expressão de marcadores de senescência e um subconjunto de fatores SASP-chave em comparação com o tratamento com veículo (Fig. 7h) Em suma, os dados sugerem que PCC1 pode efetivamente esgotar células positivas para SA-β-Gal, controlar a expressão de SASP e minimizar a carga de células senescentes em condições in vivo em camundongos. uma, Esquema do procedimento experimental para ratos experimentando WBI e testes de função física. b, Comparação instantânea de corpo inteiro de camundongos machos C57BL / 6J que foram ingênuos, expostos a WBI seguido por tratamento com veículo ou expostos a WBI e tratados com PCC1, respectivamente. c, Uma imagem na gaiola de animais descritos em uma sob condições pré-clínicas. d, Imagens representativas da coloração de SA-β-Gal de tecido cardíaco de camundongos não tratados (naive) e tratados com WBI submetidos a tratamento com veículo ou PCC1. Barra de escala, 200 μm. E, Imagens representativas de coloração de SA-β-Gal de tecido pulmonar de camundongos, conforme descrito em d. Barra de escala, 200 μm. f, Estatísticas comparativas de coloração de SA-β-Gal de tecido cardíaco de animais examinados em d. g, Estatísticas comparativas de coloração de SA-β-Gal de tecido pulmonar de animais examinados em E. h, Medição quantitativa da expressão de SASP no nível de transcrição em tecidos coletados de animais tratados sob as condições descritas em uma. eu,j, Medição da distância de corrida na esteira (eu) e força de preensão (j) de ratos experimentais. Por f-j, P os valores foram calculados por dois lados t-testes. para, Análise de sobrevivência Kaplan-Meier de camundongos C57BL / 6J expostos a WBI e tratados semanalmente com veículo ou PCC1, com camundongos ingênuos como controle não tratado. IC, intervalo de confiança; HR, razão de risco; DFI, intervalo livre de doença. P os valores foram calculados por testes de log-rank bilateral (Mantel-Cox). Os dados em gráficos de barras são mostrados como média ± dp e são representativos de três experimentos independentes. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Em seguida, avaliamos o impacto dos tratamentos pré-clínicos sobre os parâmetros físicos dos camundongos. Como esperado, o WBI comprometeu significativamente a capacidade de exercício e a força muscular medida pela esteira e ensaios de força de preensão no grupo do veículo (Fig. 7i, j) Em contraste, a administração do PCC1 proporcionou um benefício substancial, restaurando essas capacidades. Mais importante, o tratamento com PCC1 aumentou a taxa de sobrevivência (Fig. 7k) Nossos resultados indicam que a eliminação induzida por PCC1 de células senescentes SA-β-Gal-positivas pode ser uma estratégia eficaz para aliviar a regressão física relacionada à senescência e reduzir a mortalidade em contextos de envelhecimento prematuro desencadeado por estressores ambientais, como terapia citotóxica. Em seguida, procuramos definir o impacto das células senescentes na função física de animais que envelhecem naturalmente. Para este propósito, tratamos camundongos WT normais de 20 meses de idade com veículo (etanol-polietilenoglicol 400-Phosal 50 PG em 10:30:60) ou PCC1 (20 mg por kg via injeção ip) (uma vez a cada 2 semanas) por 4 meses (Fig. 8a) A avaliação histológica revelou uma porcentagem significativamente elevada de células senescentes positivas para SA-β-Gal no rim, fígado, pulmão e próstata de animais idosos, que foi revertida por tratamento com PCC1 (Fig. 8b, c e dados estendidos Fig. 8a-f) Os resultados dos testes físicos mostraram que o PCC1 aliviou a disfunção física ao aumentar a velocidade máxima de caminhada, resistência ao pendurar, força de preensão, resistência em esteira, atividade diária e desempenho de equilíbrio da viga de animais administrados com PCC1 em comparação com aqueles tratados com veículo (Fig. 8d – i), O peso corporal e a ingestão de alimentos permaneceram praticamente inalterados em camundongos tratados com PCC1 (Extended Data Fig. 8g, h) Notavelmente, a expressão do SASP foi significativamente reduzida em tecidos, como os pulmões de camundongos idosos tratados com PCC1 em comparação com o grupo tratado com veículo (Fig. 8j), um padrão consistente com menor secreção de fatores SASP por tecidos do estroma humano tratados com PCC1 (Fig. 5f) uma, Desenho esquemático para exame físico de camundongos machos C57BL / 6J de 20 meses de idade tratados com PCC1 uma vez a cada 2 semanas (quinzenalmente) durante 4 meses. b, Imagens representativas da coloração de SA-β-Gal de rins de camundongos jovens e idosos tratados com veículo ou PCC1. Barra de escala, 200 μm. c, Quantificação da coloração de SA-β-Gal conforme descrito em b. Os dados representam a média ± dp d-h, Quantificação da velocidade máxima de caminhada (em relação à linha de base) (d), resistência à suspensão (E), força de preensão (f), resistência em esteira (g) e atividade diária (h) de camundongos machos C57BL / 6J de 20 meses de idade após o tratamento de 4 meses. eu, Quantificação do tempo necessário para cruzar a trave de equilíbrio. Os pontos de dados antes e depois do tratamento de cada animal são conectados para permitir a comparação direta dos efeitos do tratamento. j, Perfil de transcrição quantitativa da expressão de SASP em tecidos pulmonares coletados de camundongos não tratados com 6 meses de idade (6M), tratados com veículo de 24 meses (veículo 24M) e tratados com PCC1 de 24 meses (24M-PCC1) . Os dados são mostrados como média ± dp e foram derivados de três réplicas biológicas (n = 3 ensaios independentes). para, Desenho esquemático para análises de tempo de vida de camundongos (ambos os sexos) aos 24-27 meses de idade. eu,m, Sobrevivência pós-tratamento (eu) e sobrevivência ao longo da vida (m) curvas de animais C57BL / 6J tratados quinzenalmente com PCC1 (n = 91; 48 homens, 43 mulheres) ou veículo (n = 80; 42 homens, 38 mulheres) começando aos 24-27 meses de idade. n, Velocidade máxima de caminhada e resistência ao enforcamento em média ao longo dos últimos 2 meses de vida (n = 10 ratos por grupo) e tempo de vida para os ratos de vida mais longa (20 primeiros) em ambos os grupos. o, Carga da doença e carga do tumor na morte. Para ambos os sexos, n = 60 ratos por braço. Para homens, n = 31 para PCC1 e n = 33 para veículo. Para mulheres, n = 29 para PCC1 e n = 27 para veículo. Por c-h,j, n = 3 ensaios biologicamente independentes. Os dados são exibidos como gráficos de caixa e bigode, em que uma caixa se estende do 25º ao 75º percentil com a mediana mostrada como uma linha no meio, e os bigodes indicam os valores menores e maiores (d-h,n) ou como média ± dp (o) Não emparelhado de duas caudas t-testes (c-j,n,o) e modelos de regressão de risco proporcional de Cox (eu,m) foram usados para determinar a significância estatística. Para estabelecer o potencial de eliminação de células senescentes para estender a vida útil restante dos camundongos WT, realizamos o tratamento com PCC1 começando em uma idade muito avançada (Fig. 8k) Os camundongos que receberam a administração de PCC1 (uma vez a cada 2 semanas ou quinzenal) começando aos 24-27 meses de idade (aproximadamente o equivalente a uma idade de 75-90 anos em humanos) tiveram uma vida média pós-tratamento 64,2% mais longa (ou 9,4% mais no geral tempo de vida) e menor risco de mortalidade (65,0%, P <0,0001) do que o grupo tratado com veículo (Fig. 8l, m) Esses dados indicam que o PCC1 pode diminuir significativamente o risco de mortalidade associada à idade em camundongos idosos. Em seguida, questionamos se a redução na taxa de mortalidade em animais idosos acarretava um aumento na morbidade na idade avançada. Medimos a função física em ratos experimentais tratados com PCC1 ou veículo mensalmente até a morte. Apesar do maior tempo de vida restante em camundongos tratados com PCC1, a função física nos últimos 2 meses de vida não foi significativamente menor do que nos camundongos tratados com veículo (Fig. 8n) Após a autópsia, a incidência de várias patologias relacionadas à idade, carga tumoral e causa de morte não foram significativamente diferentes entre camundongos tratados com PCC1 e tratados com veículo (Fig. 8o e dados estendidos Fig. 9a, b) No entanto, a expressão do SASP foi reduzida em órgãos sólidos, o que foi amplamente compatível com o declínio dos níveis circulantes de interleucina (IL) -6, fator estimulador de colônias (CSF) 2 e proteína quimioatraente de monócitos (MCP) 1, marcadores SASP representativos no sangue periférico (Extended Data Fig. 9c - f) Também observamos diminuição da expressão do SASP em CD3+ Células T no sangue periférico (Extended Data Fig. 9g), uma linhagem celular que exibe um aumento robusto em p16INK4a expressão durante o envelhecimento humano54. Além disso, o tratamento com PCC1 reduziu o estresse oxidativo nos tecidos do fígado, como evidenciado por uma diminuição nos adutos do produto de peroxidação lipídica 4-hidroxinonenal (HNE) e um aumento na proporção de glutationa reduzida para oxidada (Figura de dados estendidos 9h, eu), consistente com as propriedades gerais dos flavonóides, que exercem atividade antioxidante neutralizando os radicais livres e ativando o sistema de defesa antioxidante55,56. Em suma, o agente senolítico PCC1, um componente fitoquímico derivado de GSE (ou alternativamente, em menor abundância, de produtos naturais como extratos de canela, cacau, cascas de maçã e casca de pinheiro), pode reduzir a carga de células senescentes e possivelmente outras células desenvolver um fenótipo pró-inflamatório e inerentemente dependente de vias anti-apoptóticas associadas à senescência pró-sobrevivência e aumentar a vida útil pós-tratamento sem causar morbidade elevada em camundongos. Apresentamos aqui evidências de prova de princípio de que, mesmo quando administrado na idade avançada, tal modalidade terapêutica tem potencial proeminente para retardar notavelmente a disfunção relacionada à idade, reduzir doenças relacionadas à idade e melhorar as condições de saúde, proporcionando assim um novo caminho para melhorar expectativa de saúde e expectativa de vida na medicina geriátrica do futuro. O envelhecimento é um processo essencialmente inevitável que causa declínio funcional progressivo em quase todos os organismos. A senescência celular, um estado de interrupção permanente do crescimento, emergiu recentemente como uma marca registrada e impulsionadora do envelhecimento3,57. As células senescentes se acumulam em tecidos envelhecidos ao longo do tempo e contribuem para uma lista crescente de patologias58. A eliminação de células senescentes de progeróides ou camundongos naturalmente envelhecidos estende a expectativa de saúde, aumenta a expectativa de vida e restringe distúrbios relacionados à idade, incluindo, mas não se limitando a, aterosclerose, osteoartrite e doenças neurodegenerativas59,60,61,62. Avanços recentes em estudos relacionados à idade levaram a uma busca por drogas que podem alvejar seletivamente células senescentes, particularmente uma nova classe de agentes geroprotetores denominados senolíticos ou, menos agressivamente, senomórficos. Até o momento, um punhado de senolíticos foi relatado, incluindo dasatinibe e quercetina, fisetina, piperlongumina, inibidores da proteína de choque térmico (HSP) 90 e inibidores da família BCL-2, como ABT-263 (navitoclax) e ABT-737 (refs. 11,12,13,18,19,21,22) Entre eles, os inibidores de BCL-2 são os senolíticos mais amplamente utilizados, embora originalmente desenvolvidos como terapias para o linfoma. ABT-737 tem como alvo BCL-2, BCL-xL e BCL-w, mas com baixa solubilidade e biodisponibilidade oral. Mais eficaz para uso in vivo, ABT-263 inibe principalmente BCL-2 e BCL-xL, enquanto freqüentemente causa trombocitopenia. Dados os marcados efeitos colaterais de alguns compostos senolíticos, é necessário identificar novos compostos com atividade senolítica, mas com citotoxicidade reduzida. Neste estudo, nós rastreamos uma biblioteca de drogas baseada em PDMA composta principalmente de produtos naturais com o objetivo de identificar novo (s) agente (s) que podem visar amplamente as células senescentes com eficácia e segurança in vivo ideais. Como resultado, identificamos o PCC1, um agente fitoquímico derivado de fontes naturais, como um composto senolítico de amplo espectro. Como uma vantagem especial, PCC1 pode, alternativamente, atuar como um agente senomórfico para minimizar a expressão de SASP quando usado em baixas concentrações. Tal característica vantajosa do PCC1 na verdade se assemelha muito ao do GSE, que pode gerar efeitos senomórficos e senolíticos. Estratégias genéticas e farmacológicas demonstraram uma série de benefícios da eliminação de células senescentes para retardar o envelhecimento e controlar doenças. A senescência celular pode ser desencadeada por uma variedade de estímulos, desde ativação oncogênica, estresse genotóxico, até resposta inflamatória e exaustão replicativa. Vários compostos são identificados como senolíticos de amplo espectro, enquanto outros são seletivos contra apenas um certo tipo de célula senescente. As diferenças na especificidade implicam escolhas individuais de senolíticos, que dependem principalmente de seu uso clínico pretendido. Um estudo recente revelou a ouabaína, um composto natural pertencente à família dos glicosídeos cardíacos, como um agente senolítico que pode ser usado tanto para eliminação de células senescentes quanto para terapia de câncer, esta última implementada por meio de um mecanismo de ação duplo63. Neste trabalho, descobrimos o PCC1 como outro novo senolítico natural e potente, que seletivamente e especificamente induz a apoptose de células senescentes, mas com citotoxicidade limitada para células em proliferação64. Digno de nota, em concentrações mais baixas, o PCC1 inibe a expressão de SASP, uma propriedade compartilhada por alguns flavonóides derivados de plantas, como apigenina e caempferol, que podem atuar como senomórficos para limitar o impacto das células senescentes em condições relacionadas à idade65,66. Embora poucos estudos tenham divulgado esse mecanismo duplo de agentes naturais no direcionamento de células senescentes, o Fe funcionalizado de superfície de quercetina recentemente sintetizado3O4 nanopartículas exibiram potencial senolítico e senomórfico em fibroblastos humanos, aumentando a atividade da proteína quinase ativada por AMP (AMPK)67. O mecanismo pelo qual o PCC1 atinge os efeitos senolíticos parece complexo e requer um estudo mais aprofundado. Nossos dados sugerem que o PCC1 prejudica a integridade funcional da mitocôndria, comprometendo Δψm, levando ao aumento da produção de radicais livres como ROS e causando a liberação de citocromo c em células senescentes, mas não em células em proliferação. Uma possível razão para esta especificidade é que as células senescentes tendem a desenvolver uma membrana plasmática despolarizada e têm concentrações aumentadas de H+ (ref. 64), um recurso que pode torná-los mais suscetíveis à ação do PCC1. Digno de nota, essas alterações são acompanhadas por expressão regulada positivamente de fatores pró-apoptóticos, especificamente NOXA e PUMA, eventos que também promovem criticamente a apoptose de células senescentes. Dentro da família das procianidinas, cujos membros são conhecidos por derivar da polimerização de moléculas de flavan-3-ol e existem como oligômeros ou polímeros28, O PCC1 parece ser funcionalmente exclusivo. Nossos dados experimentais implicam em uma diferença perceptível entre PCC1 (um trímero) e outras procianidinas (a maioria das quais são de fato monômeros ou dímeros, como PCB2). Uma vez que não analisamos exaustivamente os membros da família da procianidina, se o número de monômeros na molécula determina seu potencial anti-senescência permanece uma questão aberta, mas intrigante, e os mecanismos subjacentes merecem estudos continuados no futuro. A senescência celular per se é um processo altamente heterogêneo que depende de diferentes origens celulares e estímulos ambientais.68. Uma das principais características do PCC1 é sua capacidade de limpar células senescentes com eficiência em um amplo espectro de tipos de células e estressores, incluindo replicação, oncogenes, irradiação e quimioterapia. Neste estudo, comparamos o PCC1 com outros senolíticos relatados para efeitos nas células do estroma humano, fibroblastos, HUVECs e MSCs, os principais tipos de células no microambiente do tecido. Conforme relatado, ABT-263 elimina fibroblastos embrionários humanos senescentes (HEFs) e HUVECs, mas tem pouco efeito sobre pré-adipócitos humanos12,18. O uso combinado de dasatinibe e quercetina pode esgotar todos os três tipos de células senescentes de uma maneira dependente da dose, mas é tóxico para células em proliferação11,69,70. Fisetina, outro flavonóide natural relatado como um agente senolítico, exibe efeitos modestos em HEFs senescentes e pré-adipócitos apenas em altas concentrações20,21. Em contraste, o PCC1 tem potencial para superar essas limitações, incluindo dependência do tipo de célula, alta toxicidade em células não senescentes e baixa eficiência contra células senescentes. Embora, quando usada sozinha, a quercetina (outro flavonóide em GSE) per se exiba citotoxicidade contra células estromais senescentes, sua eficácia é geralmente menor do que a de PCC1 (compare a Fig. 2a, c e Figs suplementares. 3n e 4n) Juntos, o PCC1 tem uma atividade senolítica superior com alta especificidade e eficiência para uma ampla gama de tipos de células do que muitos senolíticos relatados, como ABT-263, dasatinibe, quercetina e fisetina e pode ter como alvo células senescentes geradas por vários tipos principais de indutores de senescência. Descobrimos que o PCC1 exerce um efeito indutor de apoptose em células senescentes sob condições in vivo. PCC1 eliminou células senescentes induzidas por terapia de forma eficaz e reduziu marcadores de senescência em órgãos sólidos, destacando sua eficácia in vivo. Neste estudo, também tratamos camundongos naturalmente envelhecidos com PCC1 e testamos seus efeitos em células senescentes, inflamação crônica e função física. Em primeiro lugar, o tratamento com PCC1 esgotou as células senescentes em vários tecidos e diminuiu as assinaturas associadas a SASP, conforme mostrado pela análise GSEA. Em segundo lugar, o PCC1 pode suprimir a expressão de genes associados a SASP em fígados e rins idosos e reduzir a inflamação crônica de baixo grau no sangue. Terceiro, o PCC1 aliviava a função motora prejudicada, o equilíbrio, o exercício exausto, a força muscular e a exploração espontânea em camundongos idosos. Mais importante, o desempenho no RotaRod e no teste de equilíbrio do feixe no grupo tratado com PCC1 foi melhorado em comparação com o da condição de pré-tratamento inicial. Coletivamente, o composto fitoquímico PCC1 visa seletivamente as células senescentes no microambiente do tecido e gera efeitos biológicos notáveis em camundongos naturalmente envelhecidos. Semelhante às contrapartes sintetizadas quimicamente, as procianidinas derivadas naturalmente manifestam atividades antiinflamatórias, antiartríticas, antialérgicas e anticâncer, eliminam os radicais livres de oxigênio e suprimem a atividade de peroxidação induzida por radiação36,71. Como um trímero de epicatequina isolado de material vegetal, mais proeminentemente de sementes de uva, PCC1 demonstrou oferecer benefícios à saúde em condições patológicas crônicas72. No entanto, uma avaliação completa dos efeitos toxicológicos do PCC1 in vivo é crucial para uma aplicação clínica potencial. Nossos dados mostraram que o tratamento com alta concentração (20 mg por kg) e alta frequência com PCC1 (quinzenal) não apresentou toxicidade sistêmica aparente. Em resumo, nosso estudo demonstra a superioridade e segurança relativa de uma estratégia geroprotetora que visa seletivamente células senescentes em tecidos envelhecidos ou danificados por tratamento em um amplo espectro de tipos de células. No entanto, é possível que as concentrações de PCC1 in vivo variem entre os órgãos e dependam da dose administrada, da farmacodinâmica e da farmacocinética e que as concentrações locais não sejam altas o suficiente para atingir um efeito senolítico em alguns tipos de tecido. Nesse caso, Ao todo, nosso estudo abre um novo caminho para estender a expectativa de saúde e prolongar a expectativa de vida e tratar patologias relacionadas à idade com um agente senoterapêutico (com potencial senomórfico e senolítico), que é derivado de fontes naturais e possui eficácia pronunciada. Os potenciais efeitos anti-envelhecimento do PCC1 demonstrados em nossos ensaios pré-clínicos fornecem um bom suporte para o desenvolvimento translacional e clínico do PCC1, com o objetivo geral de alcançar uma vida mais longa e mais saudável.Principal
Resultados
Baixas concentrações de GSE restringem a expressão de SASP
GSE tem atividade senolítica em altas concentrações
O componente PCC1 de GSE tem atividade senolítica
PCC1 induz disfunção mitocondrial em células senescentes
PCC1 promove a regressão do tumor e reduz a quimiorresistência

A remoção de células senescentes como resultado do tratamento com PCC1 alivia a disfunção física
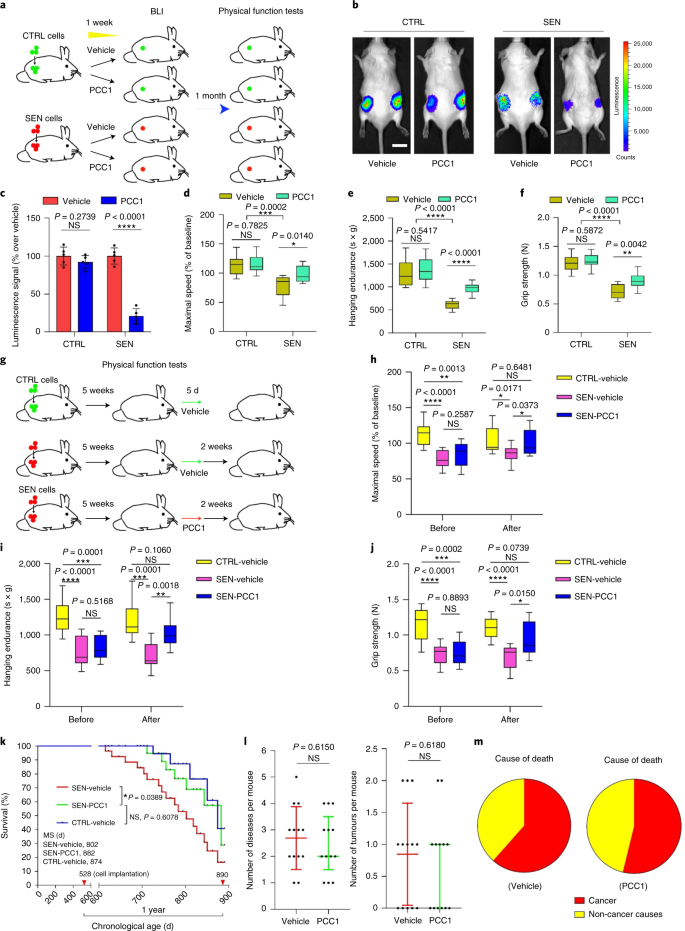
PCC1 mantém a função física e prolonga a sobrevivência de camundongos idosos
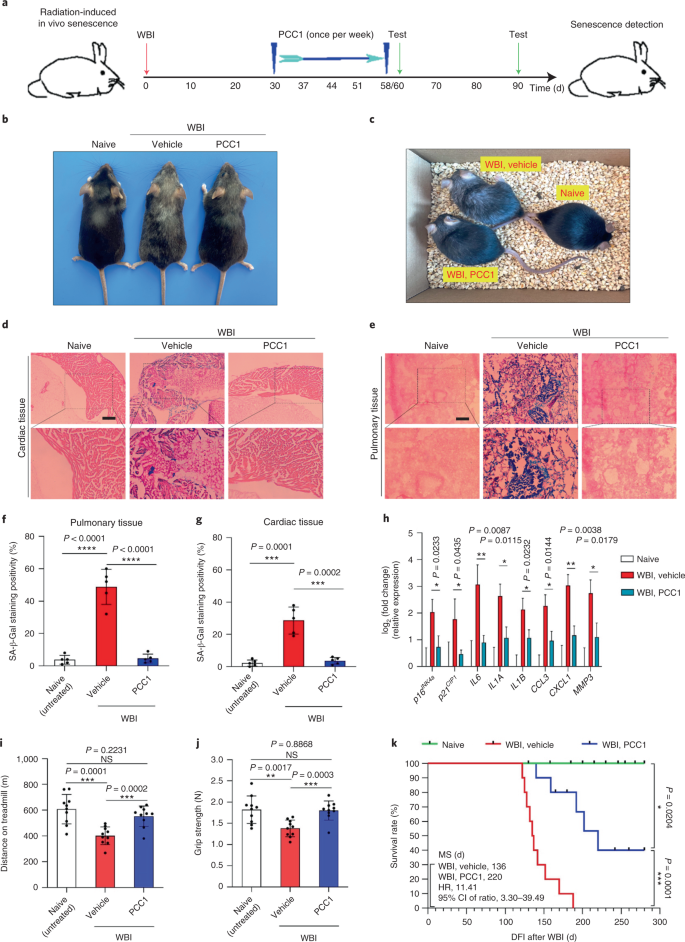
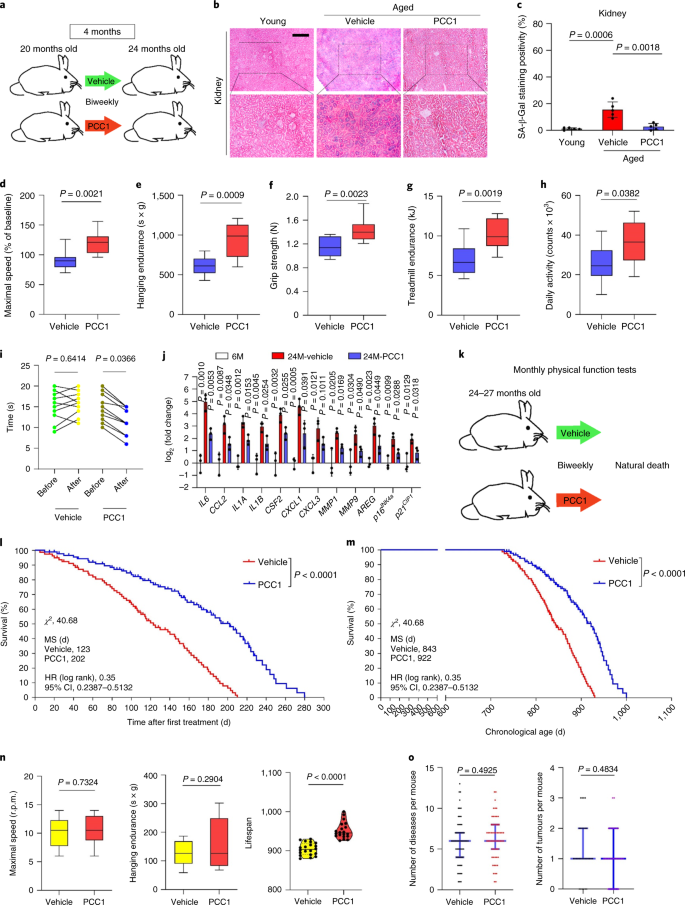
Discussão




